Membres de l'équipe
Martin Lardy
Approches physiques de la dynamique cellulaire et de la morphogenèse tissulaire
Nous cherchons à comprendre les principes physiques qui sous-tendent la morphogenèse des animaux. Pour ce faire, nous développons et appliquons des approches quantitatives pour observer, perturber et prévoir les mouvements morphogénétiques.
Notre travail porte sur des questions fondamentales de la morphogenèse des systèmes multicellulaires : comment les cellules génèrent, transmettent et répondent aux forces mécaniques, de l’échelle supramoléculaire à l’échelle multicellulaire ? Comment ces forces sont-elles couplées aux processus de signalisation et de différenciation cellulaires ? Comment les structures organisées et fonctionnelles émergent-elles de ces interactions ? Pour répondre à ces questions, nous nous concentrons sur trois aspects de la morphogenèse :
(1) L’organisation et la dynamique supramoléculaire des contacts cellulaires;
(2) La mécanique des contacts cellulaires et leur remodelage;
(3) Les changements d’état mécano-chimiques dans l’auto-organisation multicellulaire.
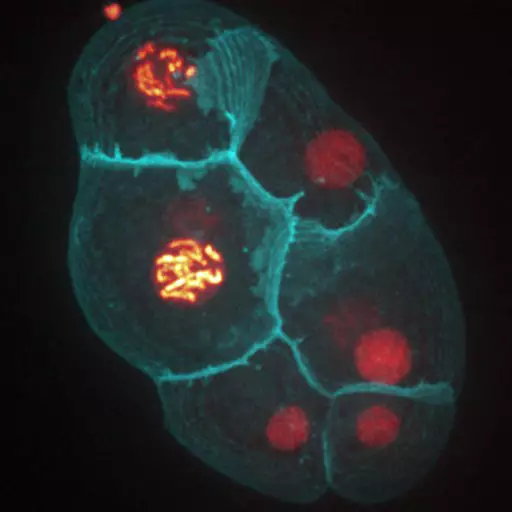
Nous développons des approches à la fois expérimentales et théoriques pour étudier plusieurs systèmes multicellulaires in vivo et in vitro : les embryons de drosophile et de C. elegans, et les organoïdes embryonnaires de souris. L’originalité de notre approche réside dans l’intégration à la fois de la physique (imagerie/mécanique/modélisation) et de la biologie expérimentale pour étudier la morphogenèse tissulaire de manière quantitative.
Publications
Super-resolution imaging uncovers the nanoscopic segregation of polarity proteins in epithelia
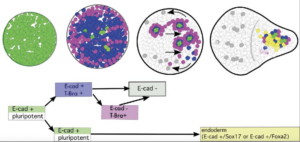
Cell-state transitions and collective cell movement generate an endoderm-like region in gastruloids
Roadmap for the multiscale coupling of biochemical and mechanical signals during development
Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis
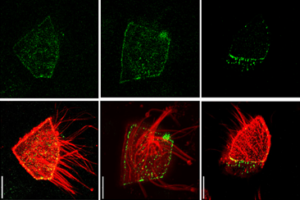
Principles of E-Cadherin Supramolecular Organization In Vivo
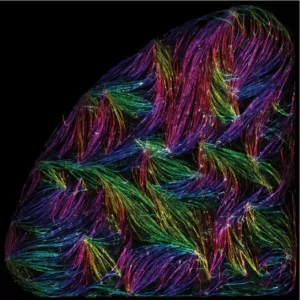
Tension-driven multi-scale self-organisation in human iPSC-derived muscle fibers
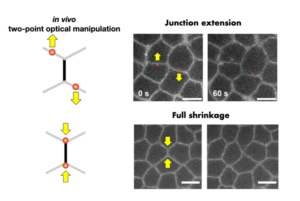
Two-Point Optical Manipulation of Cell Junctions in the Early Epithelium of the Drosophila Embryo
A detector-independent quality score for cell segmentation without ground truth in 3D live fluorescence microscopy
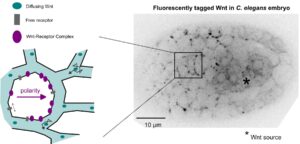
Establishment of Wnt ligand-receptor organization and cell polarity in the C. elegans embryo
Marangoni-like tissue flows enhance symmetry breaking of embryonic organoids
Two-point optical manipulation reveals mechanosensitive remodeling of cell-cell contacts in vivo
Learning the mechanobiology of development from gastruloids
Two-point optical manipulation reveals mechanosensitive remodeling of cell-cell contacts in vivo
Super-resolution imaging uncovers the nanoscopic segregation of polarity proteins in epithelia
Cell-state transitions and collective cell movement generate an endoderm-like region in gastruloids
Sculpting with stem cells: how models of embryo development take shape
Roadmap for the multiscale coupling of biochemical and mechanical signals during development
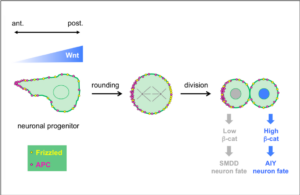
Wnt ligands regulate the asymmetric divisions of neuronal progenitors in C. elegans embryos
Experimental validation of force inference in epithelia from cell to tissue scale
Distinct contributions of tensile and shear stress on E-cadherin levels during morphogenesis
Viscoelastic Dissipation Stabilizes Cell Shape Changes during Tissue Morphogenesis
Patterned cortical tension mediated by N-cadherin controls cell geometric order in the Drosophila eye.
Laser Ablation to Probe the Epithelial Mechanics in Drosophila.
Molecular clustering in the cell: from weak interactions to optimized functional architectures.
Measuring forces and stresses in situ in living tissues.
Calcium Spikes in Epithelium: study on Drosophila early embryos.
Direct laser manipulation reveals the mechanics of cell contacts in vivo.
Superresolution measurements in vivo: imaging Drosophila embryo by photoactivated localization microscopy.
Probing cell mechanics with subcellular laser dissection of actomyosin networks in the early developing Drosophila embryo.
Clustering of low-valence particles: structure and kinetics.
Setting-up a simple light sheet microscope for in toto imaging of C. elegans development.
Principles of E-Cadherin Supramolecular Organization In Vivo
Cortical forces in cell shape changes and tissue morphogenesis.
Bond flexibility and low valence promote finite clusters of self-aggregating particles.
Calcium signaling in developing embryos: focus on the regulation of cell shape changes and collective movements.
FCS diffusion laws in two-phase lipid membranes: determination of domain mean size by experiments and Monte Carlo simulations.
Force generation, transmission, and integration during cell and tissue morphogenesis.
Planar polarized actomyosin contractile flows control epithelial junction remodelling.
Probing cell-surface dynamics and mechanics at different scales.
Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis
Fluorescence fluctuations analysis in nanoapertures: physical concepts and biological applications.
Raft nanodomains contribute to Akt/PKB plasma membrane recruitment and activation.
A two-tiered mechanism for stabilization and immobilization of E-cadherin.
Cell surface mechanics and the control of cell shape, tissue patterns and morphogenesis.
Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork.
Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization
Enhancement of single-molecule fluorescence detection in subwavelength apertures.
Actualités
Et pourtant ils diffusent!
Dans les embryons de C. elegans les ligands Wnt diffusent dans le tissu pour polariser des cellules à distance.
Lost in translation: Vangl2 short and long
La traduction commence par une Méthionine: Vrai, mais pas toujours, comme le montre une étude sur Vangl2.
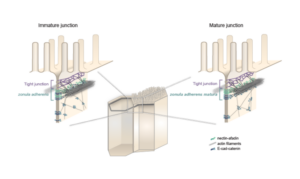
Les équipes Lenne et Le Bivic démontrent une nouvelle organisation pour les jonctions d’adhérence intestinales.
L’IBDM inspire les jeunes esprits : en impliquant les enfants des écoles primaires dans la lutte contre le cancer pédiatrique (“Contre le cancer, j’apporte ma pierre”) et en interagissant avec les lycéens grâce à des expériences immersives (DECLICS).
Les tissus épithéliaux sous tension: une étude explore comment les cellules se déforment individuellement et résistent aux forces.
Le groupe Lenne, ainsi que trois autres groupes, Merkel (CNRS), Trivedi (EMBL) et Ruprecht (CRG), se lancent dans ce projet !
Les cellules musculaires s’auto-organisent en faisceaux de fibres in vitro, sans la présence de signaux externes !
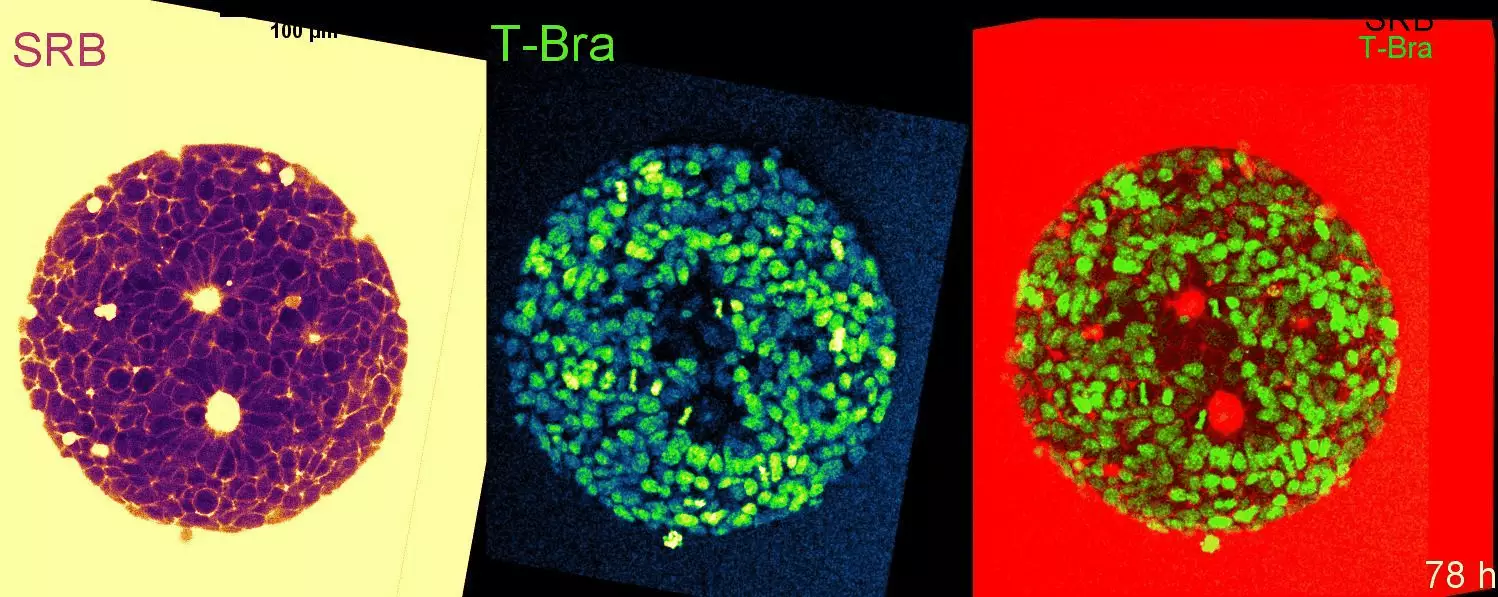
Cell-state transitions and collective cell movement generate an endoderm-like region in gastruloids
L’équipe de Lenne a publié dans Elife : En utilisant des gastruloïdes (agrégats 3D de cellules souches embryonnaires de souris), l’équipe a étudié, à une résolution cellulaire, la spécification de l’endoderme.
7 équipes de l’IBDM ont reçu une bourse ANR
7 équipes de l’IBDM ont reçu des subventions de l’Agence Nationale pour la Recherche (ANR) en 2021. Félicitations à Vincent Bertrand, Harold Cremer, Pascale Durbec,
Pierre-Francois Lenne élu membre de l’EMBO
Le 7 juillet 2020, 63 scientifiques de renom ont été élus membre de l’European Molecular Biology Organization (EMBO), en reconnaissance de leurs remarquables réalisations dans le domaine des sciences de la vie.
Dans une étude collaborative publiée dans Development, les équipes de Vincent Bertrand et de Pierre-François Lenne ont analysé le rôle de ligands Wnt lors des divisions générant des neurones au cours du développement du système nerveux.
Dans une étude récente parue dans la revue internationale Nature, Thomas Lecuit et ses collègues de l’Institut de Biologie du Développement de Marseille décrivent comment les changements de forme des tissus sont auto-organisés.
Un poste d’ingénieur en biologie est à pourvoir à partir de septembre 2022 dans le groupe de PF Lenne à l’Institut de Biologie du Développement
The Munro (Chicago, USA), Lenne and Ruprecht (Marseille, France) groups seek 2-3 postdoctoral fellows to join a newly funded (NSF/ANR) international collaboration. The overall goal of this