Membres de l'équipe
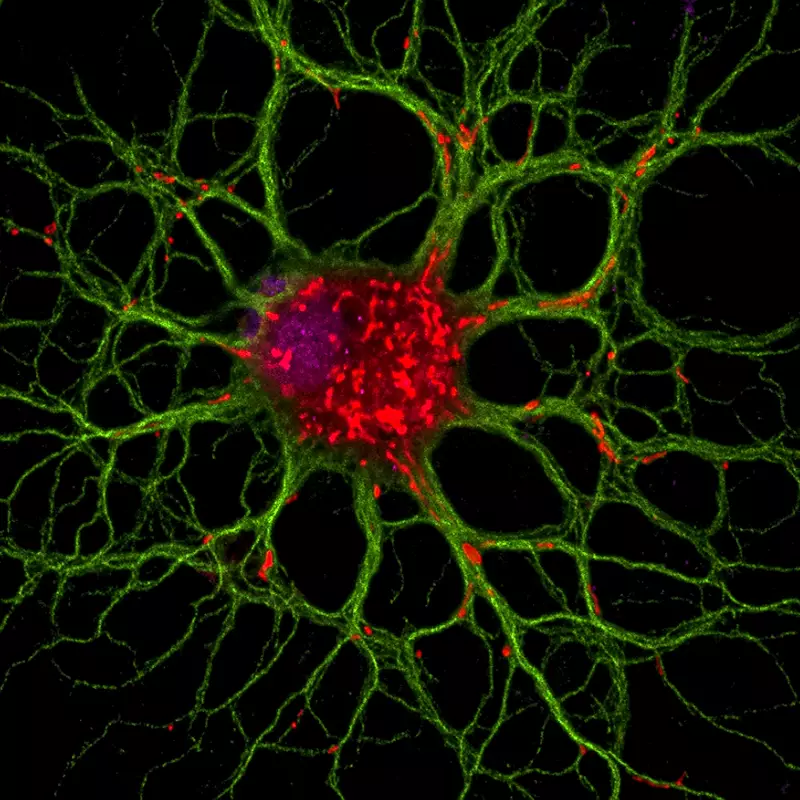
Cellules souches et réparation du cerveau
Notre équipe cherche à comprendre le processus de réparation du cerveau adulte et plus particulièrement la régénération de la myéline.
La myéline est une gaine qui entoure et isole le nerf, et améliore la transmission du signal. Lorsque la myéline est endommagée ou anormale, en raison d’anomalies génétiques, de traumatismes ou de maladies neurodégénératives comme la sclérose en plaques, des troubles neurologiques apparaissent, entraînant un handicap sévère.
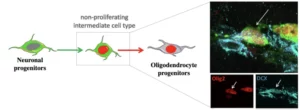
Le système nerveux est capable, dans une certaine mesure, de régénérer la gaine de myéline, mais ce processus d’auto-réparation est incomplet et insuffisant. Cette régénération est possible grâce à la présence dans le cerveau de cellules souches et de cellules progénitrices qui peuvent remplacer les oligodendrocytes la cellule formant la myéline. Il est donc important de comprendre tous les mécanismes impliqués dans le processus de réparation de la myéline afin de développer de nouvelles stratégies thérapeutiques.
Notre recherche vise à mieux comprendre la biologie des cellules progénitrices et souches adultes impliquées dans la remyélinisation. Notre objectif est de déchiffrer les mécanismes cellulaires et moléculaires contrôlant la mobilisation de ces cellules. Nous essayons de déterminer quelles cellules sont impliquées dans le processus de réparation. Comment ces cellules migrent vers le site de la lésion. Quels sont les facteurs qui contrôlent leur différenciation en oligodendrocytes dans des conditions physiologiques et pathologiques ? Nous recherchons des facteurs qui peuvent influencer ou contrôler ces événements lorsqu’ils sont administrés à l’animal. Nous utilisons la souris comme organisme modèle et combinons des techniques de biologie cellulaire, d’imagerie moléculaire et de neurochirurgie pour répondre à ces questions.
Publications
Nos dernières publications
Top
Tout
Top
Region and dynamic specificities of adult neural stem cells and oligodendrocyte precursors in myelin regeneration in the mouse brain
B.Brousse
Et Al.
K.Magalon
P.Durbec
M.Cayre
Tout
Region and dynamic specificities of adult neural stem cells and oligodendrocyte precursors in myelin regeneration in the mouse brain
B.Brousse
Et Al.
K.Magalon
P.Durbec
M.Cayre
Oligodendrogenesis in the normal and pathological central nervous system.
E.Waly B
Et Al.
M.M
C.M
D.P.
RAE-1 is expressed in the adult subventricular zone and controls cell proliferation of neurospheres.
Control of planar divisions by the G-protein regulator LGN maintains progenitors in the chick neuroepithelium.
M.X
Et Al.
J.F
�.P.
Actualités
de l'équipe
Articles
Offres d'emploi
Articles
10/08/2021
7 équipes de l’IBDM ont reçu une bourse ANR
7 équipes de l’IBDM ont reçu des subventions de l’Agence Nationale pour la Recherche (ANR) en 2021. Félicitations à Vincent Bertrand, Harold Cremer, Pascale Durbec,
Une étude récemment publiée dans elife par l’équipe de P. Durbec en collaboration avec A. Williams a montré que les cellules OLG matures épargnées par le processus dégénératif entourant les lésions démyélinisées contribuent également à ce mécanisme de réparation en produisant des HS et en modulant la voie de signalisation Shh.
Offres d'emploi
No jobs opportunities found..
Les membres du service
Ils dirigent nos recherches
Chercheur
Alumni
Ils ont contribué à nos activités
Magali Macchi
Enseignant chercheur chez Aix-Marseille Université
Xavier Morin
Chercheur CNRS
Françoise Padilla
Responsable Equipe Imagerie Photonique
Fabienne Alfonsi
Directrice du marketing médical chez Teoxane Laboratories