Membres de l'équipe
Kenza LARIBI
Réseaux de régulation transcriptionnelle dans le développement et les maladies
Notre laboratoire vise à comprendre les mécanismes qui contrôlent le développement normal et comment leur dérégulation provoque des maladies, avec un intérêt particulier pour le syndrome de délétion 19q12 caractérisé par des malformations congénitales du tractus rénal et le trouble du spectre autistique, qui sont associés à l'haplo-insuffisance du gène TSHZ3.
Notre laboratoire vise à comprendre les mécanismes qui contrôlent le développement normal et comment leur dérégulation provoque des maladies. Nous avons identifié un nouveau syndrome de délétion du chromosome 19q12 (19q12DS). Ce syndrome est une maladie génétique rare causée par l’absence d’une copie du gène TSHZ3. Les symptômes les plus fréquents chez les personnes atteintes du 19q12DS sont les malformations congénitales de l’appareil rénal (CAKUT) et les troubles du spectre autistique (TSA). Le TSA résulte d’anomalies du développement neurologique. Il se caractérise par des déficits dans les interactions sociales et des comportements, intérêts ou activités restreints et répétitifs. Le diagnostic de l’autisme est principalement clinique et basé sur des observations comportementales. À ce jour, il n’existe aucun traitement pour les TSA. Comme la physiopathologie des TSA est complexe, nous avons généré des souris dépourvues d’une copie du gène Tshz3 pour modéliser le syndrome. La caractérisation de ces souris a confirmé la présence de déficits dans l’interaction sociale et les comportements répétitifs et des champs d’intérêt restreints, ainsi que des anomalies des voies urinaires. Notre objectif principal est d’acquérir plus de connaissances sur “où, quand et comment” le gène Tshz3 est essentiel pour le développement et la fonction de certains circuits neuronaux et du tractus rénal comme base pour la recherche de nouvelles stratégies de traitement.
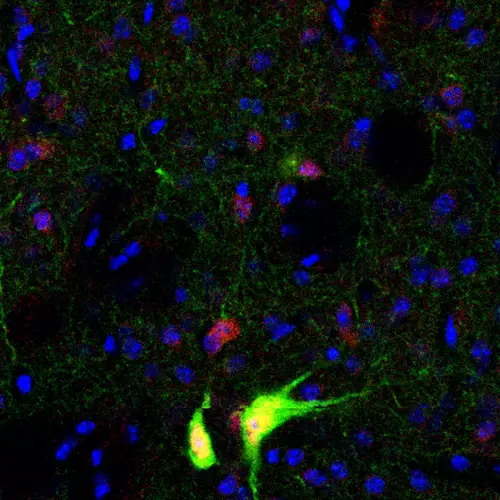
À cette fin, nous effectuons une caractérisation moléculaire, cellulaire et comportementale détaillée de nouveaux modèles de souris Tshz3. Cette approche a déjà permis de découvrir que 1) la délétion postnatale de Tshz3 chez la souris entraîne des déficits dans l’interaction sociale et les comportements répétitifs et 2) la perte de fonction de Tshz3 dans les neurones de projection corticaux est responsable des déficits d’interaction sociale, tandis que sa perte dans les interneurones cholinergiques du striatum produit des comportements répétitifs.
Publications
Targeted Tshz3 deletion in corticostriatal circuit components segregates core autistic behaviors
Haploinsufficiency of the mouse Tshz3 gene leads to kidney defects
TSHZ3 deletion causes an autism syndrome and defects in cortical projection neurons
Teashirt 3 is necessary for ureteral smooth muscle differentiation downstream of SHH and BMP4
Three putative murine Teashirt orthologues specify trunk structures in Drosophila in the same way as the Drosophila teashirt gene
The gene teashirt is required for the development of Drosophila embryonic trunk segments and encodes a protein with widely spaced zinc finger motifs
Targeted Tshz3 deletion in corticostriatal circuit components segregates core autistic behaviors
Haploinsufficiency of the mouse Tshz3 gene leads to kidney defects
TSHZ3 deletion causes an autism syndrome and defects in cortical projection neurons
TSHZ3 and SOX9 Regulate the Timing of Smooth Muscle Cell Differentiation in the Ureter by Reducing Myocardin Activity.
The tiptop/teashirt genes regulate cell differentiation and renal physiology in Drosophila.
Tandem duplication of chromosomal segments is common in ovarian and breast cancer genomes.
Maintenance of antioxidant defenses of brain cells: plasma membrane glutamate transporters and beyond.
Toward a new role for plasma membrane sodium-dependent glutamate transporters of astrocytes: maintenance of antioxidant defenses beyond extracellular glutamate clearance.
Oxidative stress and prevention of the adaptive response to chronic iron overload in the brain of young adult rats exposed to a 150 kilohertz electromagnetic field.
Teashirt-3, a novel regulator of muscle differentiation, associates with BRG1-associated factor 57 (BAF57) to inhibit myogenin gene expression.
Teashirt 3 regulates development of neurons involved in both respiratory rhythm and airflow control.
Analysis of TSHZ2 and TSHZ3 genes in congenital pelvi-ureteric junction obstruction.
Teashirt 3 is necessary for ureteral smooth muscle differentiation downstream of SHH and BMP4
Tshz1 is required for axial skeleton, soft palate and middle ear development in mice.
Direct interaction between Teashirt and Sex combs reduced proteins, via Tsh’s acidic domain, is essential for specifying the identity of the prothorax in Drosophila.
Teashirt 3 expression in the chick embryo reveals a remarkable association with tendon development.
Chaetognath phylogenomics: a protostome with deuterostome-like development.
A critical role of teashirt for patterning the ventral epidermis is masked by ectopic expression of tiptop, a paralog of teashirt in Drosophila.
Restricted expression of a median Hox gene in the central nervous system of chaetognaths.
Expression patterns of the three Teashirt-related genes define specific boundaries in the developing and postnatal mouse forebrain.
Three putative murine Teashirt orthologues specify trunk structures in Drosophila in the same way as the Drosophila teashirt gene
Hox gene survey in the chaetognath Spadella cephaloptera: evolutionary implications.
Characterisation of set-1, a conserved PR/SET domain gene in Caenorhabditis elegans.
Grunge, related to human Atrophin-like proteins, has multiple functions in Drosophila development.
Cubitus interruptus acts to specify naked cuticle in the trunk of Drosophila embryos.
Vertebrate orthologues of the Drosophila region-specific patterning gene teashirt.
Characterization of the two zebrafish orthologues of the KAL-1 gene underlying X chromosome-linked Kallmann syndrome.
The role of Teashirt in proximal leg development in Drosophila: ectopic Teashirt expression reveals different cell behaviours in ventral and dorsal domains.
The levels of the bancal product, a Drosophila homologue of vertebrate hnRNP K protein, affect cell proliferation and apoptosis in imaginal disc cells.
The C-terminal domain of armadillo binds to hypophosphorylated teashirt to modulate wingless signalling in Drosophila.
Trunk-specific modulation of wingless signalling in Drosophila by teashirt binding to armadillo.
Transcriptional regulation of the Drosophila homeotic gene teashirt by the homeodomain protein Fushi tarazu.
GIF-DB, a WWW database on gene interactions involved in Drosophila melanogaster development.
The gene teashirt is required for the development of Drosophila embryonic trunk segments and encodes a protein with widely spaced zinc finger motifs
Monitoring positional information during oogenesis in adult Drosophila.
Actualités
Targeted Tshz3 deletion in corticostriatal circuit components segregates core autistic behaviors
Nos résultats apportent un éclairage nouveau sur l’implication du circuit corticostrié dans les TSA.
Les données publiées dans Hum Mol Genet. confirment que les souris hétérozygotes Tshz3 constituent un modèle qui reproduit un grand nombre des problèmes cliniques signalés chez les patients avec une délétion hétérozygote de TSHZ3.
No jobs opportunities found..