Plasticité neurale dans le développement du cancer
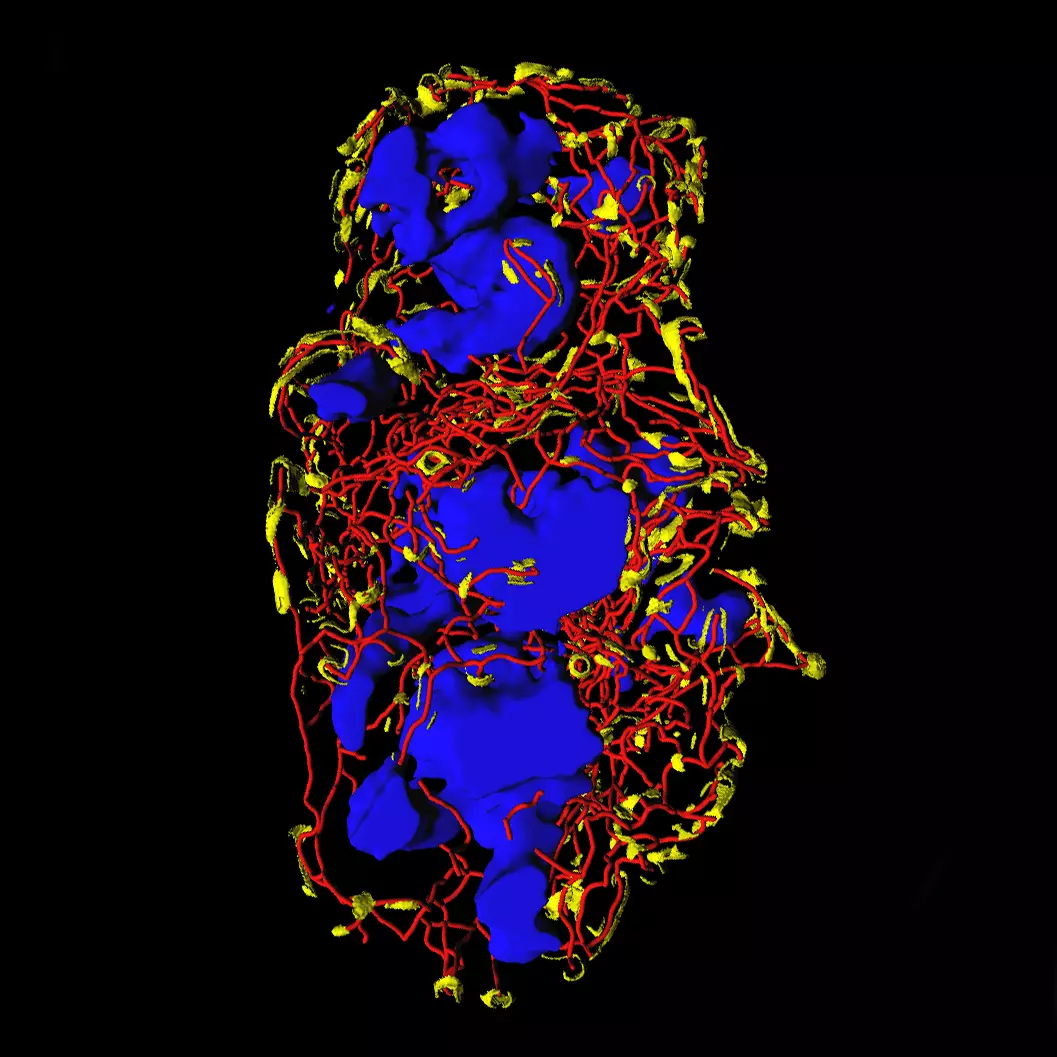
Nous cherchons à comprendre comment le système nerveux innerve les tumeurs cancéreuses afin de réguler leur développement et leur progression.
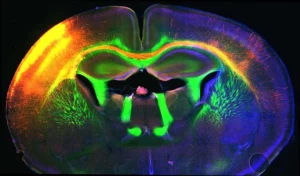
Le fonctionnement du système nerveux repose sur des réseaux neuronaux très sophistiqués qui se forment pendant la vie fœtale et l’enfance. Pendant le développement, les neurones émettent de longs câbles, appelés axones, pour atteindre leurs cellules cibles et établir des contacts synaptiques. Ce processus est contrôlé par des groupes de cellules spécialisées qui expriment des signaux de guidage et dirigent les axones selon des trajectoires spécifiques. Les projections nerveuses ainsi établies sont maintenues tout au long de la vie adulte. Loin d’être statiques, elles conservent un degré de plasticité qui leur permet de se remodeler en fonction de nos expériences ou en réponse à des maladies comme le cancer. En effet, les tumeurs malignes sont capables de stimuler la repousse d’axones matures et de favoriser ainsi leur propre innervation. L’importance de ce phénomène sur l’évolution de la maladie commence seulement à être comprise : le système nerveux a un effet protecteur ou, au contraire, accélérateur du développement tumoral, qui dépend à la fois du type de cancer et des propriétés biochimiques des axones infiltrés. Ces résultats soulèvent des questions fondamentales auxquelles nous cherchons à répondre :
Comment les projections axonales se remodèlent-elles au cours du développement d’une tumeur ?
Comment la combinaison de signaux chimiques et mécaniques générés par la tumeur contrôle-t-elle la croissance et la plasticité axonale ?
Comment les neurones interagissent-ils avec les cellules du microenvironnement tumoral et contribuent-ils à la progression de la maladie ?
Publications
VPS35 deficiency in the embryonic cortex leads to prenatal cell loss and abnormal development of axonal connectivity
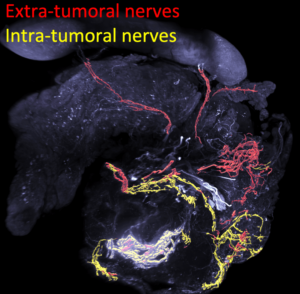
Sympathetic axonal sprouting induces changes in macrophage populations and protects against pancreatic cancer
Developmental Upregulation of Ephrin-B1 Silences Sema3C/Neuropilin-1 Signaling during Post-crossing Navigation of Corpus Callosum Axons
Post-endocytic sorting of Plexin-D1 controls signal transduction and development of axonal and vascular circuits
Microtubule-associated protein 6 mediates neuronal connectivity through Semaphorin 3E-dependent signalling for axonal growth
Semaphorin 3E Suppresses Tumor Cell Death Triggered by the Plexin D1 Dependence Receptor in Metastatic Breast Cancers
Neuronal miR-17-5p contributes to interhemispheric cortical connectivity defects induced by prenatal alcohol exposure.
VPS35 deficiency in the embryonic cortex leads to prenatal cell loss and abnormal development of axonal connectivity
Sympathetic axonal sprouting induces changes in macrophage populations and protects against pancreatic cancer
PlexinD1 and Sema3E determine laminar positioning of heterotopically projecting callosal neurons.
Developmental Upregulation of Ephrin-B1 Silences Sema3C/Neuropilin-1 Signaling during Post-crossing Navigation of Corpus Callosum Axons
Post-endocytic sorting of Plexin-D1 controls signal transduction and development of axonal and vascular circuits
Neuropilin-dependent and -independent signaling of the guidance molecule Sema3E
Characterizing Semaphorin Signaling Using Isolated Neurons in Culture
Microtubule-associated protein 6 mediates neuronal connectivity through Semaphorin 3E-dependent signalling for axonal growth
Dysfunctional SEMA3E signaling underlies gonadotropin-releasing hormone neuron deficiency in Kallmann syndrome
Sema3E/PlexinD1 regulates the migration of hem-derived Cajal-Retzius cells in developing cerebral cortex
Semaphorin 3E Suppresses Tumor Cell Death Triggered by the Plexin D1 Dependence Receptor in Metastatic Breast Cancers
Navigation rules for vessels and neurons: cooperative signaling between VEGF and neural guidance cues.
Pathfinding of corticothalamic axons relies on a rendezvous with thalamic projections.
Integration of repulsive guidance cues generates avascular zones that shape mammalian blood vessels.
Semaphorin 3C is not required for the establishment and target specificity of the GABAergic septohippocampal pathway in vitro.
Sema3E-PlexinD1 signaling selectively suppresses disoriented angiogenesis in ischemic retinopathy in mice.
Transient neuronal populations are required to guide callosal axons: a role for semaphorin 3C.
PlexinD1 glycoprotein controls migration of positively selected thymocytes into the medulla.
Gating of Sema3E/PlexinD1 signaling by neuropilin-1 switches axonal repulsion to attraction during brain development.
Semaphorin 3E and plexin-D1 control vascular pattern independently of neuropilins.
Actualités
Alcool et développement du cerveau
L’équipe Mann identifie le microARN-17-5p comme responsable des défauts de connectivité cérébrale liés à l’alcool.
NeuroStories 2022: Emprise de tête
Mike Altounian, de l’équipe Cremer, a présenté ses travaux sur les effets de l’alcool sur le développement des circuits neuronaux.
Nerveux Mais Sympathique !
Dans cette étude, l’équipe de Mann a montré que le développement du cancer du pancréas favorise le branchement et la croissance des axones sympathiques.
No jobs opportunities found..