Évolution et morphogenèse des épithéliums
Notre équipe étudie l'origine et l'évolution des caractéristiques définissant les tissus épithéliaux (jonctions intercellulaires, polarité apico-basale, membrane basale) et les signaux biomécaniques qui les contrôlent.
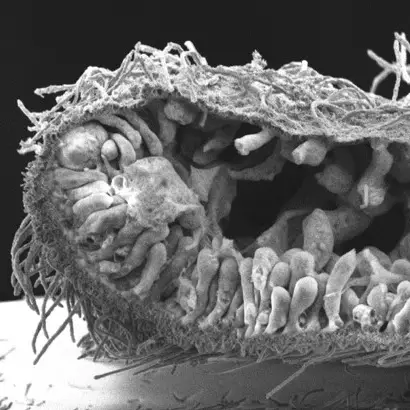
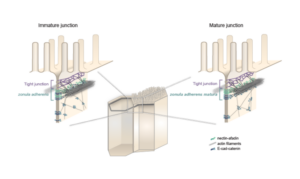
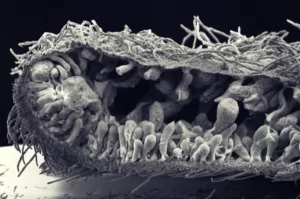
Les épithéliums sont des couches de cellules polarisées apico-basales et planes, reliées par des jonctions intercellulaires et reposant sur une lame basale. Cette organisation permet aux épithéliums de résister aux contraintes internes et/ou externes, ainsi que de définir une compartimentalisation du milieu nécessaire à l’homéostasie. La formation des épithéliums a donc été déterminante pour que les animaux apparaissent et évoluent dans toute la diversité de formes que nous pouvons observer aujourd’hui. L’objectif de notre équipe est de comprendre comment les épithéliums se sont formés au cours de l’évolution et comment leurs caractéristiques sont conservées ou modifiées des éponges à l’homme. Comme les épithéliums expriment de nombreux gènes impliqués dans la formation des jonctions cellulaires ou dans l’établissement de la polarité cellulaire, nous étudions leur rôle à l’aide de techniques de pointe en biologie moléculaire, cellulaire et tissulaire. Nous avons montré que de nombreux gènes essentiels à la construction des jonctions et à la polarité apico-basale chez l’homme et dont les mutations sont associées à des cancers sont déjà présents chez les éponges apparues il y a entre 600 et 800 M d’années. Nos travaux sur les cellules épithéliales intestinales humaines montrent que des protéines de polarité comme PAR6B ou CRB3 sont nécessaires pour que ces cellules s’organisent en monocouche ou modulent leur cytosquelette d’actine interne pour migrer. Nous étudions maintenant le rôle de ces molécules dans la transmission des forces entre les cellules épithéliales en utilisant des approches physiques de pointe. De plus, nous décryptons la composition des jonctions à la fois dans une éponge de la baie de Marseille et dans un placozoaire pour comprendre comment ces structures sont apparues et ont évolué au cours de l’évolution animale. En adoptant ces différentes approches, nous espérons répondre à des questions importantes en biologie cellulaire animale.
Publications
Super-resolution imaging uncovers the nanoscopic segregation of polarity proteins in epithelia
Evolution of mechanisms controlling epithelial morphogenesis across animals: new insights from dissociation-reaggregation experiments in the sponge Oscarella lobularis
New genomic data and analyses challenge the traditional vision of animal epithelium evolution
The elmo-mbc complex and rhogap19d couple Rho family GTPases during mesenchymal-to-epithelial-like transitions
Crumbs, Moesin and Yurt regulate junctional stability and dynamics for a proper morphogenesis of the Drosophila pupal wing epithelium.
Role of the crumbs proteins in ciliogenesis, cell migration and actin organization
Crb3 is required to organize the apical domain of multiciliated cells
Super-resolution imaging uncovers the nanoscopic segregation of polarity proteins in epithelia
Evolution of mechanisms controlling epithelial morphogenesis across animals: new insights from dissociation-reaggregation experiments in the sponge Oscarella lobularis
New genomic data and analyses challenge the traditional vision of animal epithelium evolution
The elmo-mbc complex and rhogap19d couple Rho family GTPases during mesenchymal-to-epithelial-like transitions
Crumbs, Moesin and Yurt regulate junctional stability and dynamics for a proper morphogenesis of the Drosophila pupal wing epithelium.
Animal multicellularity and polarity without Wnt signaling.
Role of the crumbs proteins in ciliogenesis, cell migration and actin organization
Binding of ZO-1 to α5β1 integrins regulates the mechanical properties of α5β1-fibronectin links.
Quantitative methods to study epithelial morphogenesis and polarity
The PCP pathway regulates Baz planar distribution in epithelial cells.
Hook2, a microtubule-binding protein, interacts with Par6α and controls centrosome orientation during polarized cell migration
P-cadherin-mediated Rho GTPase regulation during collective cell migration.
The localisation of the apical Par/Cdc42 polarity module is specifically affected in microvillus inclusion disease.
Segmentation and Quantitative Analysis of Epithelial Tissues.
Draft Genome Sequence of an Alphaproteobacterium Associated with the Mediterranean Sponge Oscarella lobularis.
Mitochondrial Genome Sequence of the Glass Sponge Oopsacas minuta.
The Crumbs3 complex
CRB2 acts as a modifying factor of CRB1-related retinal dystrophies in mice.
Drebrin E depletion in human intestinal epithelial cells mimics Rab8a loss of function.
Targeted Ablation of Crumbs1 and Crumbs2 in Retinal Progenitor Cells Mimics Leber Congenital Amaurosis.
The multi-PDZ domain protein-1 (MUPP-1) expression regulates cellular levels of the PALS-1/PATJ polarity complex.
Primary cilium migration depends on G-protein signalling control of subapical cytoskeleton.
Evolution and Cell Physiology. 4. Why invent yet another protein complex to build junctions in epithelial cells?
Loss of CRB2 in the mouse retina mimics human retinitis pigmentosa due to mutations in the CRB1 gene.
Actualités
Les équipes Lenne et Le Bivic démontrent une nouvelle organisation pour les jonctions d’adhérence intestinales.
Fais ton stage à l’IBDM !
Tu es à la recherche de ton stage de Master ? L’IBDM te semble être le bon endroit pour le faire ? Découvre nos offres dès maintenant.
Andrea Pasini, dans l’équipe Le Bivic, a récemment obtenu un financement du programme CNRS
Andrea Pasini, dans l’équipe Le Bivic, a récemment obtenu un financement du programme CNRS “Diversité des Mécanismes Biologiques”, pour étudier la plasticité épithéliale de Trichoplax.
7 équipes de l’IBDM ont reçu une bourse ANR
7 équipes de l’IBDM ont reçu des subventions de l’Agence Nationale pour la Recherche (ANR) en 2021. Félicitations à Vincent Bertrand, Harold Cremer, Pascale Durbec,
We are looking for candidates wishing to apply to a CENTURI Program PhD fellowship to work on the cell biology of epithelia in the emerging model Trichoplax.
Interplay of cellular forces, adhesion and mechanics during colorectal cancer progression
The intern will develop skills in cell biology (cell culture, immunofluorescence, confocal imaging) and will be trained to use advanced biophysical tools (deformable hydrogel beads, atomic force microscopy).
Sensing mechanical forces during epithelial remodeling in the Placozoan Trichoplax adhaerens
The M1 student will learn micromanipulation, live confocal imaging, immunofluorescence and quantitative modelling techniques.
Applicants should be interested in the quantitative aspects of cell biology, with a particular focus on marine organisms.
Wanted! Highly motivated candidates wishing to apply for an Aix-Marseille University PhD fellowship to work on the cell biology of epithelia in the emerging model Trichoplax adhaerens. On cherche des candidat-e-s à une bourse doctorale de Aix-Marseille Université pour étudier la biologie des épithéliums dans un organisme-modèle émergeant, Trichoplax adhaerens.