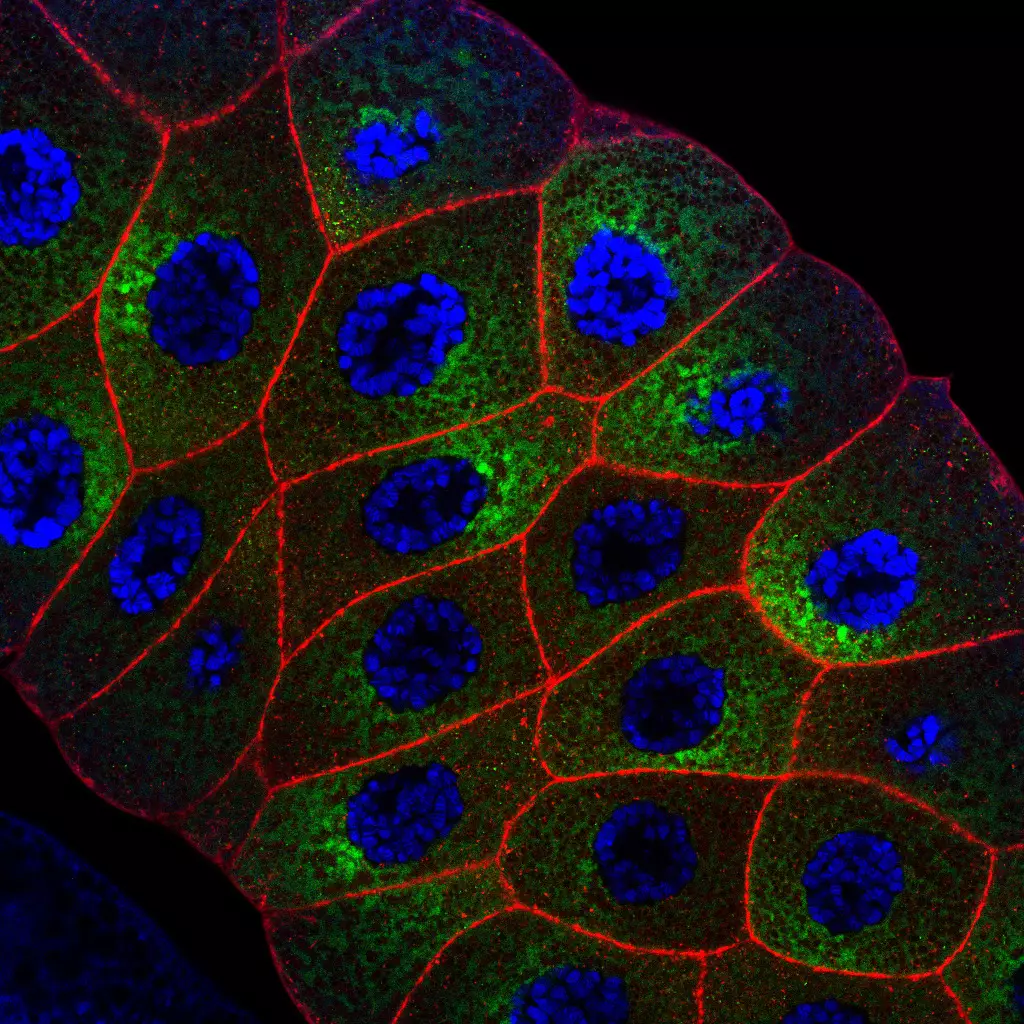
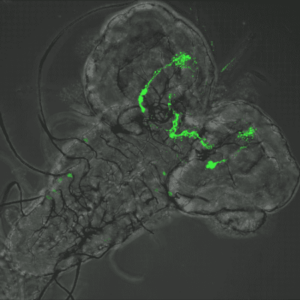
Interaction hôte-pathogène dans le modèle de la drosophile
Notre équipe étudie, au niveau moléculaire, l'impact des bactéries sur le métabolisme et le comportement de leurs hôtes.
Les eucaryotes vivent dans des niches écologiques diversifiées qui, bien que variables en termes de caractéristiques physiques et chimiques, sont toutes colonisées par des micro-organismes tels que des bactéries, des virus ou des champignons. Il s’ensuit que, dès les premiers stades de leur développement et jusqu’à leur mort, les animaux interagissent pour le meilleur et pour le pire avec ces co-habitants. Pour le meilleur, car les microbes peuvent avoir un impact positif sur divers paramètres physiologiques de l’hôte tels que la fécondité, la longévité et la croissance, pour n’en citer que quelques-uns. Pour le pire, puisque, évidemment, certains de ces microbes peuvent avoir un effet négatif sur l’hôte et peuvent même parfois mettre sa vie en danger. Pour se défendre, les eucaryotes ont développé des stratégies immunitaires pour identifier les microorganismes environnants et déclencher des réponses ad hoc qui éradiquent les envahisseurs et assurent l’intégrité et la forme physique de l’hôte et de sa descendance. Des études récentes soulignent les avantages de faire entrer les neurones dans le jeu complexe de l’interaction hôte-microbe. Les neurones sensoriels jouent un rôle dans l’identification des microbes et, donc, dans la distinction entre ceux qui sont bénéfiques et avec lesquels il faut vivre et d’autres, potentiellement pathogènes, qu’il faut éviter. A l’inverse, les neurones de l’hôte peuvent être détournés par les micro-organismes et les produits dérivés des microbes pour faciliter leur prolifération au sein des animaux infectés. En outre, la perception par le système nerveux d’une menace microbienne peut permettre à l’hôte de modifier son comportement afin de réduire les conséquences de l’infestation sur lui-même et sa progéniture.
Alors que les neuroscientifiques et les immunologistes continuent de découvrir des molécules agissant sur les deux systèmes et des interactions génétiques entre eux, il devient clair que les systèmes immunitaire et neuronal partagent de nombreux composants et coopèrent à différents niveaux pour permettre à un animal de vivre en harmonie avec ses microbes exogènes et endogènes. À l’aide de sa puissante collection d’outils génétiques et génomiques, nous avons utilisé la drosophile pour comprendre comment les mécanismes immunitaires et neuronaux coopèrent pour permettre aux mouches de se protéger des microbes pathogènes ou parfois de tirer profit des microorganismes avec lesquels elles vivent.
Publications
Bacteria-Derived Peptidoglycan Triggers a Noncanonical Nuclear Factor-κB-Dependent Response in Drosophila Gustatory Neurons
Gut-derived peptidoglycan remotely inhibits bacteria dependent activation of SREBP by Drosophila adipocytes
How Bacteria Impact Host Nervous System and Behaviors: Lessons from Flies and Worms
Peptidoglycan-dependent NF-κB activation in a small subset of brain octopaminergic neurons controls female oviposition
Cytosolic and Secreted Peptidoglycan-Degrading Enzymes in Drosophila Respectively Control Local and Systemic Immune Responses to Microbiota
Peptidoglycan sensing by octopaminergic neurons modulates Drosophila oviposition
Role of Rab5 early endosomes in regulating Drosophila gut antibacterial response
Bacteria-Derived Peptidoglycan Triggers a Noncanonical Nuclear Factor-κB-Dependent Response in Drosophila Gustatory Neurons
Gut-derived peptidoglycan remotely inhibits bacteria dependent activation of SREBP by Drosophila adipocytes
How Bacteria Impact Host Nervous System and Behaviors: Lessons from Flies and Worms
Gut bacteria-derived peptidoglycan induces a metabolic syndrome-like phenotype via NF-κB-dependent insulin/PI3K signaling reduction in Drosophila renal system
Drosophila Aversive Behavior toward Erwinia carotovora carotovora Is Mediated by Bitter Neurons and Leukokinin
Peptidoglycan-dependent NF-κB activation in a small subset of brain octopaminergic neurons controls female oviposition
Cytosolic and Secreted Peptidoglycan-Degrading Enzymes in Drosophila Respectively Control Local and Systemic Immune Responses to Microbiota
Oligopeptide Transporters of the SLC15 Family Are Dispensable for Peptidoglycan Sensing and Transport in Drosophila.
Drosophila larvae food intake cessation following exposure to Erwinia contaminated media requires odor perception, Trpa1 channel and evf virulence factor
Peptidoglycan sensing by octopaminergic neurons modulates Drosophila oviposition
Inhibition of a NF-κB/Diap1 Pathway by PGRP-LF Is Required for Proper Apoptosis during Drosophila Development
Bacteria sensing mechanisms in Drosophila gut: Local and systemic consequences.
Tissue-Specific Regulation of Drosophila NF-x03BA;B Pathway Activation by Peptidoglycan Recognition Protein SC.
Drosophila Microbiota Modulates Host Metabolic Gene Expression via IMD/NF-κB Signaling.
Mutations in the Drosophila ortholog of the vertebrate Golgi pH regulator (GPHR) protein disturb endoplasmic reticulum and Golgi organization and affect systemic growth.
Mecanisms and consequences of bacteria detection by the Drosophila midgut.
The Drosophila inner-membrane protein PMI controls cristae biogenesis and mitochondrial diameter.
Peptidoglycan sensing by the receptor PGRP-LE in the Drosophila gut induces immune responses to infectious bacteria and tolerance to microbiota.
SKIV2L mutations cause syndromic diarrhea, or trichohepatoenteric syndrome.
Gut-microbiota interactions in non-mammals: what can we learn from Drosophila?
Peptidoglycan recognition proteins: modulators of the microbiome and inflammation.
Epithelial homeostasis and the underlying molecular mechanisms in the gut of the insect model Drosophila melanogaster.
Toll-8/Tollo negatively regulates antimicrobial response in the Drosophila respiratory epithelium.
Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing.
The Drosophila peptidoglycan-recognition protein LF interacts with peptidoglycan-recognition protein LC to downregulate the Imd pathway.
Polyglutamine Atrophin provokes neurodegeneration in Drosophila by repressing fat.
Inner-membrane proteins PMI/TMEM11 regulate mitochondrial morphogenesis independently of the DRP1/MFN fission/fusion pathways.
Lack of an antibacterial response defect in Drosophila toll-9 mutant.
Drosophila immune response: From systemic antimicrobial peptide production in fat body cells to local defense in the intestinal tract.
Elimination of plasmatocytes by targeted apoptosis reveals their role in multiple aspects of the Drosophila immune response.
Bacterial detection by Drosophila peptidoglycan recognition proteins.
The Drosophila membrane-associated protein PGRP-LF prevents IMD/JNK pathways triggering by blocking PGRP-LC activation.
Crystal structure of Drosophila PGRP-SD suggests binding to DAP-type but not lysine-type peptidoglycan. Molecular Immunology.
Peptidoglycan recognition proteins: pleiotropic sensors and effectors of antimicrobial defences.
Downregulation of the Drosophila Immune Response by Peptidoglycan-Recognition Proteins SC1 and SC2.
Function of the drosophila pattern-recognition receptor PGRP-SD in the detection of Gram-positive bacteria.
Infectious non-self recognition in invertebrates: lessons from Drosophila and other insect models.
Drosophila melanogaster innate immunity: an emerging role for Peptidoglycan Recognition Proteins in bacteria detection.
Toll-dependent and Toll-independent immune responses in Drosophila.
Dual activation of the Drosophila Toll pathway by two Pattern Recognition Receptors.
Silencing of Toll pathway components by direct injection of double-stranded RNA into Drosophila adult flies.
Notch signaling controls lineage specification during Drosophila larval hematopoiesis.
The Drosophila immune response against Gram-negative bacteria is mediated by a peptidoglycan recognition protein.
Drosophila Toll is activated by Gram-positive bacteria through a circulating peptidoglycan recognition protein.
Actualités
Nos travaux démontrent qu’en activant la voie NF-kB, le peptidoglycane de la paroi cellulaire produit par ces mêmes bactéries, contrecarre l’activation de SREBP dans les adipocytes de manière autonome cellulaire.
7 équipes de l’IBDM ont reçu une bourse ANR
7 équipes de l’IBDM ont reçu des subventions de l’Agence Nationale pour la Recherche (ANR) en 2021. Félicitations à Vincent Bertrand, Harold Cremer, Pascale Durbec,
Dans un article récent publié dans iScience, Bernard Charroux, Fabrice Daian and Julien Royet analysent le comportement de drosophiles simplement mises en contact avec des bactéries potentiellement pathogènes pour elles.
Julien Royet’s team uses the genetic tools generated in the fruit fly to dissect the molecular interactions between bacteria and the host’s nervous system.
No jobs opportunities found..